Trong thế giới Hóa học, việc định lượng các chất trong một hỗn hợp hay dung dịch là một yêu cầu cơ bản và tối quan trọng. Để biểu thị “độ đậm đặc” của một dung dịch, các nhà khoa học sử dụng nhiều đại lượng khác nhau, trong đó, công thức tính nồng độ phần trăm (ký hiệu C%) là một trong những khái niệm quen thuộc, phổ biến và có tính ứng dụng cao nhất. Nó không chỉ xuất hiện dày đặc trong các sách giáo khoa, các bài kiểm tra. Mà còn hiện hữu ngay trong cuộc sống hàng ngày của chúng ta, từ chai nước muối sinh lý, chai cồn y tế đến lọ giấm ăn trong nhà bếp.
Tuy nhiên, đối với nhiều học sinh, việc hiểu sâu, nhớ đúng và áp dụng thành thạo công thức tính nồng độ phần trăm vẫn còn là một thử thách. Những nhầm lẫn tai hại giữa khối lượng chất tan và khối lượng dung môi, hay sự lúng túng khi gặp các bài toán pha chế phức tạp là điều thường thấy. Bài viết này sẽ là một cuốn cẩm nang toàn diện nhất. Giúp bạn “giải mã” tất cả những gì liên quan đến công thức tính nồng độ phần trăm. Từ việc nắm vững các khái niệm nền tảng, đi sâu vào công thức, “thực chiến” với mọi dạng bài tập có ví dụ minh họa chi tiết, đến việc nhận diện các lỗi sai kinh điển. Một hành trình giúp bạn làm chủ hoàn toàn kiến thức quan trọng này.
Các Khái Niệm Nền Tảng: “Móng Nhà” Vững Chắc Cần Nắm Vững
Trước khi học cách xây một ngôi nhà, bạn phải hiểu rõ về gạch, vữa, xi măng. Tương tự, để áp dụng công thức tính nồng độ phần trăm, bạn buộc phải nắm vững các khái niệm cốt lõi sau:
1. Dung Dịch (Solution): Dung dịch là một hỗn hợp đồng nhất, trong đó có một chất bị hòa tan vào một chất khác.
- Ví dụ: Khi hòa tan muối ăn vào nước, ta thu được dung dịch nước muối.
2. Chất Tan (Solute): Chất tan là chất bị hòa tan trong dung môi để tạo thành dung dịch.
- Ký hiệu khối lượng chất tan thường là mct.
- Ví dụ: Trong dung dịch nước muối, muối ăn (NaCl) là chất tan.
3. Dung Môi (Solvent): Dung môi là chất có khả năng hòa tan chất tan.
- Ký hiệu khối lượng dung môi thường là mdm.
- Dung môi phổ biến và quan trọng nhất trong chương trình học là nước (H2O).
4. Khối Lượng Dung Dịch (Mass of Solution): Đây là khái niệm cực kỳ quan trọng và là nơi học sinh dễ mắc sai lầm nhất. Khối lượng của dung dịch là tổng khối lượng của chất tan và khối lượng của dung môi.
- Ký hiệu khối lượng dung dịch là mdd.
- Công thức liên hệ:mdd=mct+mdm
- Lưu ý “chết người”: Tuyệt đối không nhầm lẫn khối lượng dung dịch (mdd) với khối lượng dung môi (mdm) hoặc thể tích dung môi.
Công Thức Tính Nồng Độ Phần Trăm (C%) Chi Tiết
Sau khi đã có nền tảng vững chắc, chúng ta sẽ đi vào “trái tim” của bài học ngày hôm nay.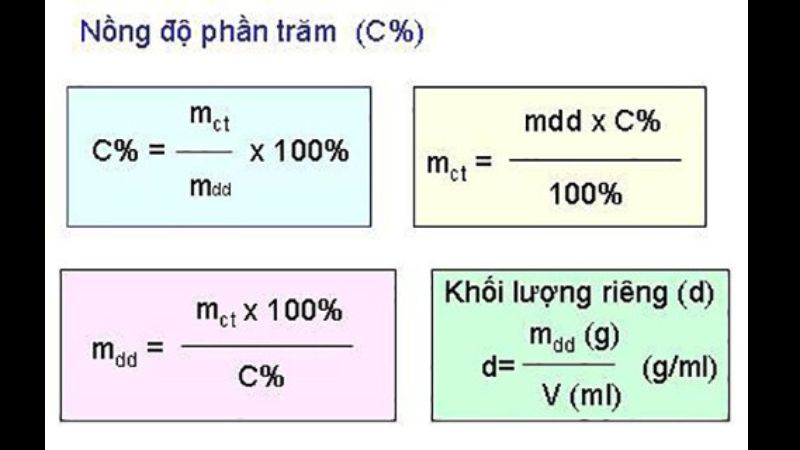
1. Định Nghĩa Nồng độ phần trăm (C%) của một dung dịch cho biết số gam chất tan có trong 100 gam dung dịch.
- Ví dụ: Dung dịch muối ăn 20% có nghĩa là trong 100g dung dịch đó, có chứa 20g muối ăn và 80g nước.
2. Công Thức Chính Công thức tính nồng độ phần trăm được biểu diễn như sau:
Trong đó:
- C%: Nồng độ phần trăm (đơn vị: %).
- mct: Khối lượng chất tan (đơn vị: gam).
- mdd: Khối lượng dung dịch (đơn vị: gam).
3. Công Thức Mở Rộng Từ công thức liên hệ mdd=mct+mdm, ta có thể viết lại công thức tính nồng độ phần trăm một cách chi tiết hơn:
Công thức mở rộng này cực kỳ hữu ích trong các bài toán cho biết khối lượng chất tan và khối lượng dung môi.
“Thực Chiến” Với Các Dạng Bài Tập Về Công Thức Tính Nồng Độ Phần Trăm
Lý thuyết sẽ trở nên sống động khi được áp dụng vào các bài tập thực tế. Dưới đây là các dạng bài tập từ cơ bản đến nâng cao.
Dạng 1: Bài Toán Thuận – Tính C% Khi Biết Các Đại Lượng Cơ Bản
Đây là dạng bài tập cơ bản nhất, áp dụng trực tiếp công thức tính nồng độ phần trăm.
- Ví dụ 1: Hòa tan hoàn toàn 25g đường saccarozơ vào 75g nước. Tính nồng độ phần trăm của dung dịch thu được.
- Phân tích:
- Chất tan là đường, mct=25 g.
- Dung môi là nước, mdm=75 g.
- Giải:
- Khối lượng dung dịch thu được là: mdd=mct+mdm=25+75=100 g.
- Áp dụng công thức tính nồng độ phần trăm: C%=mddmct×100%=10025×100%=25%.
- Kết luận: Nồng độ phần trăm của dung dịch đường là 25%.
- Phân tích:
Dạng 2: Bài Toán Nghịch – Tìm Khối Lượng Chất Tan (mct)
Từ công thức chính, ta có thể suy ra công thức tính khối lượng chất tan:
- Ví dụ 2: Cần lấy bao nhiêu gam muối NaCl để pha chế thành 200g dung dịch NaCl 15%?
- Phân tích:
- Khối lượng dung dịch cần pha: mdd=200 g.
- Nồng độ phần trăm mong muốn: C%=15%.
- Giải:
- Áp dụng công thức tính mct: mct=100%15%×200=30 g.
- Kết luận: Cần lấy 30g muối NaCl (và 200−30=170g nước) để pha dung dịch.
- Phân tích:
Dạng 3: Bài Toán Nghịch – Tìm Khối Lượng Dung Dịch (mdd) Hoặc Dung Môi (mdm)
Tương tự, ta có công thức tính khối lượng dung dịch:
- Ví dụ 3: Hòa tan 40g NaOH vào nước thì thu được dung dịch NaOH 20%. Tính khối lượng dung dịch và khối lượng nước đã dùng.
- Phân tích:
- Khối lượng chất tan: mct=40 g.
- Nồng độ phần trăm dung dịch: C%=20%.
- Giải:
- Áp dụng công thức tính mdd: mdd=20%40×100%=200 g.
- Khối lượng nước (dung môi) đã dùng là: mdm=mdd−mct=200−40=160 g.
- Kết luận: Khối lượng dung dịch thu được là 200g, khối lượng nước đã dùng là 160g.
- Phân tích:
Dạng 4: Bài Toán Pha Loãng Hoặc Cô Đặc Dung Dịch
Đây là dạng bài toán nâng cao hơn, đòi hỏi sự biện luận.
- Nguyên tắc vàng: Khi pha loãng (thêm dung môi) hoặc cô đặc (làm bay hơi dung môi), khối lượng chất tan (mct) không thay đổi.
- Ví dụ 4: Làm bay hơi 100g nước từ 500g dung dịch muối 10%. Hỏi dung dịch sau khi cô đặc có nồng độ phần trăm là bao nhiêu?
- Phân tích:
- Dung dịch ban đầu: mdd1=500 g, C%1=10%.
- Lượng nước bay hơi: 100 g.
- Giải:
- Khối lượng chất tan trong dung dịch ban đầu (không đổi): mct=100%C%1×mdd1=100%10%×500=50 g.
- Khối lượng dung dịch sau khi cô đặc: mdd2=mdd1−mnước bay hơi=500−100=400 g.
- Áp dụng công thức tính nồng độ phần trăm cho dung dịch mới: C%2=mdd2mct×100%=40050×100%=12.5%.
- Kết luận: Nồng độ dung dịch mới là 12.5%.
- Phân tích:
Phân Biệt Nồng Độ Phần Trăm (C%) và Nồng Độ Mol (CM) – Công thức tính nồng độ phần trăm
Trong Hóa học, bên cạnh C% còn có một đại lượng nồng độ rất quan trọng khác là nồng độ mol (CM). Việc phân biệt rõ hai khái niệm này là rất cần thiết.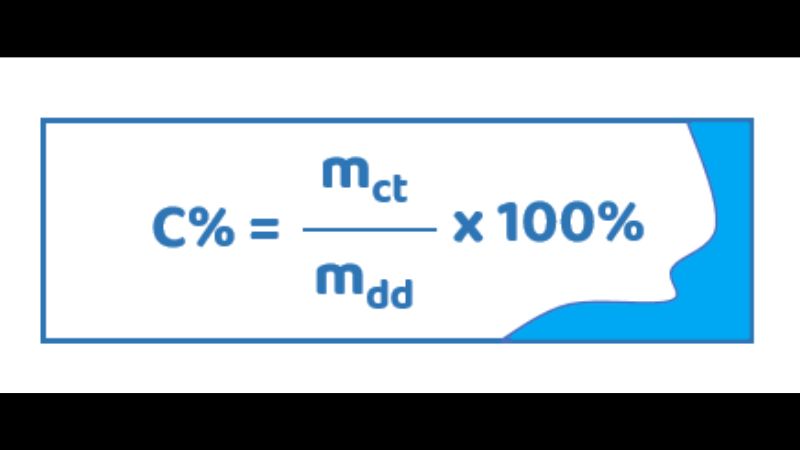
| Tiêu chí | Nồng Độ Phần Trăm (C%) | Nồng Độ Mol (CM) |
| Định nghĩa | Số gam chất tan trong 100g dung dịch | Số mol chất tan trong 1 lít dung dịch |
| Công thức | C%=mdd/mct×100% | CM=Vn |
| Đơn vị | % | mol/lít (hoặc M) |
| Đại lượng liên quan | Khối lượng (g, kg) | Số mol (mol), Thể tích (lít) |
| Ứng dụng | Phổ biến trong thực tế, phòng thí nghiệm cơ bản, sản xuất (dược phẩm, thực phẩm). | Phổ biến trong các tính toán liên quan đến phản ứng hóa học, chuẩn độ. |
Ứng Dụng Thực Tế Của Nồng Độ Phần Trăm – Công thức tính nồng độ phần trăm
Nồng độ phần trăm không chỉ là công thức lý thuyết. Nó xuất hiện trong đời sống hàng ngày.
- Nước muối sinh lý: Dung dịch có nồng độ NaCl 0,9%. Trong 100g dung dịch có 0,9g muối. Dung dịch này được dùng để rửa vết thương và nhỏ mắt.
- Cồn y tế: Thường có nồng độ 70% hoặc 90%. Con số này biểu thị phần trăm ethanol trong dung dịch. Cồn y tế giúp sát khuẩn và khử trùng hiệu quả.
- Giấm ăn: Là dung dịch axit axetic với nồng độ khoảng 5%. Giấm được dùng trong nấu ăn và bảo quản thực phẩm.
- Nước ngọt có gas: Lượng đường trong nước ngọt cũng được biểu thị bằng nồng độ phần trăm. Nồng độ này cho biết lượng đường hòa tan trong dung dịch.
Hiểu nồng độ phần trăm giúp đo lường và cân chỉnh dung dịch chính xác. Nó đảm bảo hiệu quả y tế, an toàn thực phẩm và hương vị món ăn. Nồng độ phần trăm không chỉ hữu ích trong học tập. Nó còn thiết thực trong sinh hoạt và đời sống hàng ngày
Những Lỗi Sai “Kinh Điển” Khi Áp Dụng Công Thức Tính Nồng Độ Phần Trăm
- Nhầm lẫn giữa mdd và mdm là lỗi phổ biến nhất. Mdd luôn bằng tổng khối lượng chất tan và dung môi. Việc quên công thức này dẫn đến kết quả sai hoàn toàn.
- Không đồng nhất đơn vị là một lỗi khác thường gặp. Tất cả các đại lượng khối lượng phải cùng đơn vị. Thường thì người ta sử dụng gam. Nếu bỏ qua bước này, kết quả sẽ bị sai lệch.
- Quên nhân với 100% là một lỗi nhỏ nhưng tai hại. Nhiều người tính xong mà không nhân 100, hoặc làm vội dẫn đến nhầm lẫn. Kết quả cuối cùng sẽ không đúng.
- Sai lầm trong bài toán pha chế cũng hay xảy ra. Nhiều người quên rằng khối lượng chất tan không thay đổi khi chỉ thêm hoặc bớt dung môi. Việc này làm nồng độ phần trăm tính toán không còn chính xác.

Hiểu rõ các lỗi thường gặp giúp học sinh và sinh viên áp dụng công thức chính xác hơn. Kiểm tra từng bước, đồng nhất đơn vị và luôn nhớ nhân với 100% là cách đảm bảo kết quả đúng. Áp dụng công thức đúng sẽ giúp bài toán về nồng độ phần trăm trở nên dễ dàng và chính xác hơn trong thực tế.
Kết Luận
Công thức tính nồng độ phần trăm là một trong những viên gạch nền tảng, cơ bản và quan trọng nhất của Hóa học. Việc nắm vững không chỉ công thức, mà cả bản chất của các đại lượng liên quan, sẽ giúp các bạn học sinh tự tin giải quyết mọi dạng bài tập từ dễ đến khó. Hơn thế nữa, hiểu về C% còn giúp chúng ta có cái nhìn khoa học hơn về các sản phẩm quen thuộc trong cuộc sống hàng ngày.
Hy vọng rằng, với cẩm nang chi tiết và các ví dụ minh họa trực quan này, bạn đã có một cái nhìn toàn diện và sâu sắc về công thức tính nồng độ phần trăm. Hãy luyện tập thường xuyên, bởi “trăm hay không bằng tay quen”. Chúc các bạn thành công trên con đường chinh phục môn Hóa học!